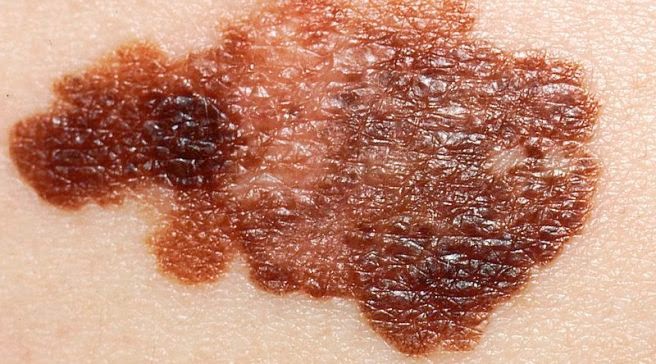
Czerniak złośliwy to jeden z najbardziej
agresywnych nowotworów. W Polsce diagnozę czerniaka słyszy około 2 tysięcy osób
rocznie. Z roku na rok nowotwór ten atakuje coraz większą liczbę osób. Wśród
ludzi rasy białej liczba zachorowań wzrosła niemal 10-krotnie w przeciągu
ostatnich 50 lat. W naszym kraju walkę z czerniakiem wygrywają 4 osoby na 10.
Powodem dużej śmiertelności jest późna diagnostyka, a także brak świadomości na
temat czynników, które są odpowiedzialne za rozwój tej choroby. Coraz większą
uwagę zwraca się także na czynniki dziedziczne.
agresywnych nowotworów. W Polsce diagnozę czerniaka słyszy około 2 tysięcy osób
rocznie. Z roku na rok nowotwór ten atakuje coraz większą liczbę osób. Wśród
ludzi rasy białej liczba zachorowań wzrosła niemal 10-krotnie w przeciągu
ostatnich 50 lat. W naszym kraju walkę z czerniakiem wygrywają 4 osoby na 10.
Powodem dużej śmiertelności jest późna diagnostyka, a także brak świadomości na
temat czynników, które są odpowiedzialne za rozwój tej choroby. Coraz większą
uwagę zwraca się także na czynniki dziedziczne.
Czynniki
ryzyka.
ryzyka.
Czerniak
złośliwy pierwotnie wywodzi się z melanocytów – komórek barwnikowych skóry.
Jest to rak o dwóch, różnych obliczach – najpierw rozwija się bardzo powoli, nie
dając żadnych objawów. Gdy liczba zmutowanych komórek osiągnie pewną wielkość –
wówczas rośnie bardzo szybko i równie szybko daje przerzuty.
złośliwy pierwotnie wywodzi się z melanocytów – komórek barwnikowych skóry.
Jest to rak o dwóch, różnych obliczach – najpierw rozwija się bardzo powoli, nie
dając żadnych objawów. Gdy liczba zmutowanych komórek osiągnie pewną wielkość –
wówczas rośnie bardzo szybko i równie szybko daje przerzuty.
Za główny czynnik ryzyka uważa się
promieniowanie ultrafioletowe. Kancerogenne działanie promieniowania UV wiąże
się przede wszystkim z pasmem UVB, które powoduje powstawanie nieprawidłowości
w DNA. Promieniowanie powoduje także zahamowanie podziałów komórkowych,
inaktywacje enzymów, a nawet śmierć komórki.
promieniowanie ultrafioletowe. Kancerogenne działanie promieniowania UV wiąże
się przede wszystkim z pasmem UVB, które powoduje powstawanie nieprawidłowości
w DNA. Promieniowanie powoduje także zahamowanie podziałów komórkowych,
inaktywacje enzymów, a nawet śmierć komórki.
Szczególnie podatne na czerniaka są osoby,
które posiadają tzw. „fenotyp
nordycki”, który charakteryzuje się bardzo jasną karnacją,
jasnymi lub rudymi włosami, niebieskimi oczami, a także występowaniem piegów na
skórze. Osoby o takim wyglądzie powinny szczególnie unikać promieniowania
słonecznego, a także stosować kremy z
wysoką ochroną przeciwsłoneczną.
które posiadają tzw. „fenotyp
nordycki”, który charakteryzuje się bardzo jasną karnacją,
jasnymi lub rudymi włosami, niebieskimi oczami, a także występowaniem piegów na
skórze. Osoby o takim wyglądzie powinny szczególnie unikać promieniowania
słonecznego, a także stosować kremy z
wysoką ochroną przeciwsłoneczną.
Osoby,
które w dzieciństwie często doświadczały poparzeń – są również w grupie
podwyższonego ryzyka. Inne czynniki to występowanie dużej liczny znamion
dysplastycznych oraz tzw. plam soczewicowatych. Zwiększone ryzyko zachorowania
na czerniaka u dzieci osób chorych na ten typ raka sugeruje, że istotnym
czynnikiem w patogenezie czerniaka są także predyspozycje genetyczne.
które w dzieciństwie często doświadczały poparzeń – są również w grupie
podwyższonego ryzyka. Inne czynniki to występowanie dużej liczny znamion
dysplastycznych oraz tzw. plam soczewicowatych. Zwiększone ryzyko zachorowania
na czerniaka u dzieci osób chorych na ten typ raka sugeruje, że istotnym
czynnikiem w patogenezie czerniaka są także predyspozycje genetyczne.
Genetyka
czerniaka.
czerniaka.
O rodzinnej agregacji mówimy wówczas, gdy
czerniak złośliwy występuje w u przynajmniej dwóch krewnych. U części rodzin
czerniak skóry występuje razem z czerniakiem gałki ocznej. Zwiększona zachorowalność
na czerniaka złośliwego powiązana jest przede wszystkim z mutacjami w genie CDKN2A. Gen ten występuje na 9 chromosomie
i koduje białka odpowiedzialne za hamowanie cyklu komórkowego. Mutacje w tym
genie sprawiają, że białka te nie powstają, przez co dochodzi do zaburzeń w
cyklu komórkowym. Aktywacja genu CDNK2A jest także niezbędna przy prawidłowym
różnicowaniu się melanocytów. Mutacje w genie CDKN2A zwiększają zachorowalność
również na nowotwory trzustki, piersi, jelita grubego i płuc.
czerniak złośliwy występuje w u przynajmniej dwóch krewnych. U części rodzin
czerniak skóry występuje razem z czerniakiem gałki ocznej. Zwiększona zachorowalność
na czerniaka złośliwego powiązana jest przede wszystkim z mutacjami w genie CDKN2A. Gen ten występuje na 9 chromosomie
i koduje białka odpowiedzialne za hamowanie cyklu komórkowego. Mutacje w tym
genie sprawiają, że białka te nie powstają, przez co dochodzi do zaburzeń w
cyklu komórkowym. Aktywacja genu CDNK2A jest także niezbędna przy prawidłowym
różnicowaniu się melanocytów. Mutacje w genie CDKN2A zwiększają zachorowalność
również na nowotwory trzustki, piersi, jelita grubego i płuc.
Mutacje w genie CDKN2A odpowiadają za
wysokie ryzyko zachorowalności na czerniaka złośliwego. Ryzyko to może
zwiększać również ekspozycja na szkodliwe czynniki środowiskowe tj.
promieniowanie UV. Dobrze poznana i scharakteryzowaną mutacja genu CDKN2A jest A148T. Zwiększa ona ponad dwukrotnie
ryzyko zachorowania na czerniaka, niezależnie od zachorowań w rodzinie,
zwłaszcza u osób w młodym wieku – przed 50 r.ż.
wysokie ryzyko zachorowalności na czerniaka złośliwego. Ryzyko to może
zwiększać również ekspozycja na szkodliwe czynniki środowiskowe tj.
promieniowanie UV. Dobrze poznana i scharakteryzowaną mutacja genu CDKN2A jest A148T. Zwiększa ona ponad dwukrotnie
ryzyko zachorowania na czerniaka, niezależnie od zachorowań w rodzinie,
zwłaszcza u osób w młodym wieku – przed 50 r.ż.
Kolejnym genem odpowiedzialnym za rozwój
czerniaka jest onkogen BRAF, który
koduje enzym – kinazę ważną w szlaku sygnałowym, który kończy się w jądrze
komórkowym, gdzie reguluje m.in. podziały komórek. Mutacja V600E genu BRAF występuje w 40-60% przypadkach czerniaka. Jest to
mutacja zmiany sensu, która prowadzi do nabycia nowej funkcji – zwiększa
aktywność kinazy przeszło 10-krotnie, co sprawia, że komórka może dzielić się
niezależnie od sygnałów z zewnątrz.
czerniaka jest onkogen BRAF, który
koduje enzym – kinazę ważną w szlaku sygnałowym, który kończy się w jądrze
komórkowym, gdzie reguluje m.in. podziały komórek. Mutacja V600E genu BRAF występuje w 40-60% przypadkach czerniaka. Jest to
mutacja zmiany sensu, która prowadzi do nabycia nowej funkcji – zwiększa
aktywność kinazy przeszło 10-krotnie, co sprawia, że komórka może dzielić się
niezależnie od sygnałów z zewnątrz.
Opracowano terapię, w której można
zahamować zmutowane białko za pomocą specjalnych inhibitorów. Lek o nazwie
wemurafenib jest zazwyczaj dobrze tolerowany przez pacjentów i znacząco
poprawia jakość i długość życia. Lek ten jednak powinien być stosowany tylko u
pacjentów, u których zdiagnozowano mutacje w genie BRAF. Stosowanie tych leków
przez chorych nieposiadających mutacji, może bowiem przynieść odwrotne skutki.
zahamować zmutowane białko za pomocą specjalnych inhibitorów. Lek o nazwie
wemurafenib jest zazwyczaj dobrze tolerowany przez pacjentów i znacząco
poprawia jakość i długość życia. Lek ten jednak powinien być stosowany tylko u
pacjentów, u których zdiagnozowano mutacje w genie BRAF. Stosowanie tych leków
przez chorych nieposiadających mutacji, może bowiem przynieść odwrotne skutki.
Aby dostosować odpowiednie leczenie
dostosowane do pacjenta to warto wykonać testy genetyczne. Dzięki nim zyskamy
wiedzę na temat posiadanych wad w genomie, co pozwoli na wprowadzenie
zdecydowanie skuteczniejszej terapii.
dostosowane do pacjenta to warto wykonać testy genetyczne. Dzięki nim zyskamy
wiedzę na temat posiadanych wad w genomie, co pozwoli na wprowadzenie
zdecydowanie skuteczniejszej terapii.
Literatura:
·
„Zastosowanie inhibitorów BRAF i MEK w
terapii zaawansowanego czerniaka”, Koseła H., Świtaj. T., Rutkowski P.,
Onkologia w Praktyce Klinicznej, 2011, tom 7, nr – 5, 246-253.
„Zastosowanie inhibitorów BRAF i MEK w
terapii zaawansowanego czerniaka”, Koseła H., Świtaj. T., Rutkowski P.,
Onkologia w Praktyce Klinicznej, 2011, tom 7, nr – 5, 246-253.
·
„Genetyka kliniczna czerniaka”, Dębniak T.,
Lubiński J., Postępy Nauk Medycznych, 8/2008, 501-503.
„Genetyka kliniczna czerniaka”, Dębniak T.,
Lubiński J., Postępy Nauk Medycznych, 8/2008, 501-503.